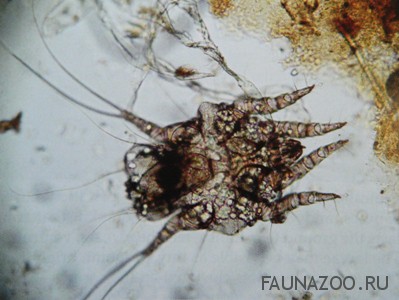
Исследование паразитов крови в наших условиях проводятся не так часто. Этот метод используют не только для диагностики экстра- и интрацелулярных паразитов крови (бабезий, лейшманий, трипаносом) при подозрении на заболевание, а также в профилактических целях при импорте животных или при возвращении с мест распространения этих паразитов.
Кровь берут натощак, то есть после 12-часовой голодной диеты из v. cephalica antebrachii, v. saphena или v. jugularis.
Костный мозг берут при помощи специальной биопсической иглы обычно из грудной кости или подвздошного бугра. Место биопсии локально анестезируют подкожным введением 1%-го Мезокаина. Биопсическую иглу вводят под углом примерно 45° к телу (в подвздошный бугор), вынимают мандрен и инъекционным шприцом создают вакуум. Из полученного пунктата готовят мазок, который высушивают при комнатной температуре. Микроскопически исследуют нативный препарат либо окрашенный одним из методов.
1. Нативный препарат.
Каплю свежевзятой крови размешивают в физиологическом растворе лучше всего на часовом стёклышке до достижения светло-розовой окраски раствора и рассматривают при среднем увеличении микроскопа. Этот метод лучше всего подходит для исследования живых трипаносом, которых можно обнаружить благодаря их активному движению.
2. Окраска мазка крови по Гимзе.
Мазок крови сушат на воздухе и фиксируют метанолом в течение 5 минут. Коммерческую концентрированную краску Романовского-Гимзе перед каждой окраской необходимо разводить заново. К 100 мл дистиллированной воды добавляют либо 4 – 5 мл (получим менее концентрированный раствор), либо 10 мл краски (более концентрированный вариант), либо 1 – 2 капли концентрированной краски к 1 мл дистиллированной воды. Дают стечь раствору с фиксированных образцов, после чего красят ещё раз менее концентрированной краской 45 минут и в более концентрированном 30 минут. Тщательно промывают водопроводной водой и снова сушат. В процессе окраски рекомендуется систематически осматривать мазки и, не обращая внимания на точное соблюдение временных интервалов исследовать образцы при оптимальной интенсивности окраски.
3. Окраска мазков крови и костного мозга паноптическим методом.
Приготавливают несколько мазков крови, а смотря по обстоятельствам, мазков из измельчённого костного мозга на чистых и тщательно обезжиренных предметных стёклах. Чем больше количество взятых образцов, тем выше вероятность обнаружения паразитов. Высушивают мазки на воздухе. На стеклянную решётку, помещённую в фоточашку, кладут мазки, готовые к окрашиванию и заливают раствором Мей-Грюнвальда (May-Grúnwald). Через 3 минуты на образцы капают примерно по 10 капель дистиллированной воды и перемешивают движением стекла. Для получения эффекта оставляют примерно на 1 минуту. После этого окрашивают свежеприготовленным раствором красителем Романовского-Гимзе, который готовят добавлением 10 капель, (то есть 0,5 мл) концентрированной краски к 10 мл буферного раствора. Через 10 минут краску сливают и споласкивают мазок водой, вытирают нижнюю сторону мазка и высушивают на воздухе. Исследуют при среднем увеличении, однако лучше с иммерсией. При оценке результатов окрашивания и постановки диагноза следует консультироваться и сравнивать результаты со специализированными лабораториями. Ложно поставленный диагноз (например, лейшманиоз, бабезиоз) может вести за собой ненужное и дорогое лечение.